Компанія Miasphera розповіла журналістам про міфи щодо вживання медичного канабісу
16 серпня 2024 року буде введений у дію Закон України «Про внесення змін до деяких законів України щодо державного регулювання обігу рослин роду коноплі (Cannabis)» № 3528-IX. Він покликаний легалізувати обіг рослин роду конопель (канабіс) у медичних, промислових цілях, науковій та науково-технічній діяльності.
Закон викликав чимало гострих дискусій у суспільстві, а також спровокував появу міфів щодо використання медичного канабісу. На професійній дискусійній панелі «Легалізація медичного канабісу: потреба, необхідність, ризики» виділили головні з них.
Насправді є достатньо наукових даних, які підтверджують, що застосування ліків на основі медичного канабісу є ефективними при лікуванні понад 50 патологічних станів, серед них:
• неврологічні захворювання;
• захворювання травного тракту;
• хронічний біль невропатичного походження;
• при наданні паліативної допомоги тощо.
В Україні це питання особливо актуальне для наступних категорій людей:
• діти з епілепсією;
• онкохворі;
• хворі, які потребують паліативної допомоги (при невиліковних хворобах);
• ветерани війни з ПТСР.
Нині використання медичного канабісу схвалили вже 56 країн. Зокрема, Німеччина, Іспанія, Нідерланди, Італія, Чехія, Франція, Португалія, Польща, Греція, Австрія, Данія, Бельгія, Норвегія, а також Ізраїль, Великобританія, США та Канада.
Закон чітко регламентує діяльність із вирощування сортів рослин роду коноплі лише в медичних, промислових, наукових та науково-технічних цілях. Будь-яке інше використання — заборонене. Держава суворо контролюватиме обіг ліків на основі канабісу, а застосування його у рекреаційних цілях, як і раніше, залишиться під забороною і вважатиметься злочином.
Щоб виготовляти і відпускати ліки на основі медичного канабісу, аптека має отримати ліцензію на здійснення діяльності з обігу наркотичних засобів, психотропних речовин та прекурсорів та ліцензії на право провадження господарської діяльності з виробництва лікарських засобів.
Ірина Морозова, засновниця компанії Miasphera надала свій експертний коментар cайту itnews: «Для пацієнтів із певними хворобами/станами легалізація медичного канабісу є порятунком. Препарати на його основі показали свою ефективність при важких формах онкології, безсонні, неврологічних захворюваннях, хронічних болях, розсіяному склерозі, ВІЛ/СНІД, хворобі Крона, хворобі Альцгеймера та інших. Також ці засоби широко використовуються для паліативної допомоги та для полегшення стану пацієнтів з епілепсією. Яскравий приклад — синдром Драве. Це важка форма епілепсії в дітей, яка має генетичні передумови та не корелюється лікарськими засобами».
Натхненна після травневої подорожі у Львів, команда Miasphera готова поділитись своїми враженнями від участі у Львівському медичному форумі та виставки ГалМЕД.
Медичний форум, що відбувся 21-23 травня, об’єднав понад 60 компаній-учасників з України та Європи, які представили сучасне медичне, стоматологічне та реабілітаційне обладнання, вироби медичного та лабораторного призначення, харчові добавки, а також новітні методики лікування.
Вся команда Miasphera ретельно готувалась до події та була неймовірно задоволена стати учасником та офіційним партнером такого масштабного заходу. Нас чекали корисні знайомства, ділові дискусії, безліч нової інформації і, звісно, трохи чарівного старовинного Львова у вільний від роботи час 🙂
В рамках виставки ГалМЕД, Miasphera організувала науково-практичну конференцію, яка була присвячена легалізації медичного канабісу та сертифікації медичних виробів. Ми залучили до професійної дискусії лікарів, юристів, фармацевтів та фахівців дотичних до галузі.
Тема медичного канабісу викликала жваву дискусію серед присутніх, а переповнений конференц-зал був прямим підтвердженням неабиякої актуальності даного питання. Ми віримо, що наш фокус на використанні канабісу в медичних цілях знайде ще більше зацікавлених серед професійної медичної спільноти України.
Miasphera вдячна усім, хто взяв активну участь в конференції та розділив ідею легалізації та потенціалу використання канабісу у медичних цілях.
Львівський медичний форум став однією з найбільших медичних подій України, і від імені усієї команди ми безмежно вдячні організаторам, партнерам та нашим ЗСУ за можливість взяти участь у подібному заході!
І наостанок, традиційно презентуємо невеличкий фотозвіт з місця подій
























Також наша компанія стала організатором дискусійної панелі, на тему: Актуальні виклики при легалізації медичного канабісу в Україні. Запис, ви можете подивитись на нашому Youtube каналі:
Процедура сертифікація партії медичних виробів– одна з основних легальних процедур, яка може бути застосована при реєстрації імпортованих медичних виробів в Україні.
Сертифікат відповідності на партію проводиться без виїзду експертів на місце виробництва. Фактично він видається на підставі чинного технічного файлу та огляду партії аудитором на митниці.
Отже, порядок проведення процедури зводиться до:
– оцінки наявного технічного файлу;
– підготовки інструкції та маркування під українське законодавство;
– оформлення договору на замовника чи Уповноваженого представника;
– аудиту партії безпосередньо на митниці;
– видачі сертифіката (орієнтовно від 3-5 днів);
– розмитнення, як медичного товару (зі ставкою оподаткування 7%).
Отримання сертифіката відповідності на партію медичного товару є економічно доцільним, якщо продукція ввозиться не системно або разово. Як правило, це постачання штучного медичного електрообладнання або однотипних медичних виробів (одна модель і одна марка).
Як довго триває процедура сертифікації партії?
Зазвичай 3-5 робочих днів, залежно від об’єму партії
До яких медичних виробів не може бути застосована процедура сертифікації партії?
– медичне програмне забезпечення;
– стерильна медична продукція;
– лабораторна апаратура, виготовлена по індивідуальному замовленню.
Бажаєте дізнатись можливість партійної сертифікації медичних виробів? Замовляйте попередню консультацію у фахівців Miasphera або телефонуйте +38 068 498 88 58
На ринку України присутній традиційно широкий асортимент дієтичних добавок. Вони охоплюють багато напрямків фізіологічної дії та мають різні форми випуску. Але часом, інформація на упаковці щодо властивостей дієтичних добавок може плутати покупців, особливо, якщо ці товари купуються в аптеках.
Тому виробнику дієтичних добавок слід приділяти особливу увагу маркуванню. Згідно з вимогами українського законодавства, вся обов’язкова інформація про продукт повинна бути надана безпосередньо на упаковці або етикетці.
Отже, коректно маркована дієтична добавка для виробника – це не тільки потужний стимул дати змогу споживачу зробити усвідомлений вибір, не вводячи його в оману, а й чітке дотримання вимог українського законодавства та мінімізація звернень з боку органів контролю.
Розуміння тонкощів сертифікації медичних виробів може здатись складним навіть для тих, хто вже неодноразово стикався з цією темою. Тому сьогодні ми поділимось корисною інформацією та розглянемо основні аспекти та питання, пов’язані з сертифікацією медичних виробів на території України.
Сертифікація медичних виробів – це процес оцінки відповідності медичного виробу вимогам Технічних регламентів, які підтверджують його безпеку та ефективність при використанні людиною.
Так! Оцінка відповідності виробів медичного призначення – це законодавча вимога, яка підтверджує їх законне введення в обіг на території України та подальшу реалізацію.
Відповідальність за декларування медичного виробу несе безпосередньо виробник або уповноважена особа, в разі, якщо медичні вироби імпортуються з інших країн.
Декларація складається під повну відповідальність виробника.
Процедура оцінки відповідності медичних виробів залежить від типу та класу безпеки медичного виробу.
Основними процедурами є самодекларування (для медичних виробів І класу ризику нестерильних, без функції вимірювання, для in vitro) та оцінка відповідності через аудит виробника (І стерильні, з функцією вимірювання, ІІа, ІІb, ІІІ).
В окремих випадках використовується процедура сертифікації партії або процедура з визнанням ЄС сертифікату.
Центральними органами регулювання та нагляду є Міністерство економічного розвитку та торгівлі, Міністерство охорони здоров’я та Держлікслужба України.
Безпосередньо оцінку відповідності медичних виробів в Україні проводять спеціально призначені органи з оцінки відповідності – акредитовані організації державної або приватної форми власності. Актуальний перелік призначених органів публікує Міністерство економічного розвитку і торгівлі.
Наші експерти супроводжують виробника на всіх етапах процедури оцінки відповідності, починаючи від консультації та збору документів і закінчуючи отриманням експертних висновків. Також ми надаємо повний юридичний супровід та послугу Уповноваженого представника.
Виникли додаткові питання? Залишайте заявку на консультацію або телефонуйте.
Ми завжди на зв’язку +38 068 498 88 58
Чи задумувались ви над тим, хто відповідає за якість та безпеку товарів імпорту? В Україні ця роль належить Уповноваженому представнику – юридичній або особі ФОП, яка має резидентство.
Слід зазначити, що наявність уповноваженого представника для будь-якого виробника-нерезидента є вимогою українського законодавства. Тому одним з перших кроків процесу сертифікації медичних виробів або косметики є призначення Уповноваженого представника виробника в Україні. Авторизований Уповноважений представник діє як офіційний посередник між виробником та ринком України, в тому числі з державними установами, відповідальними за ринковий нагляд.
Уповноважений представник має певні обов’язки, визначені Технічними регламентами та законодавчими актами:
Зазвичай, іноземні виробники обирають уповноваженого представника за власними вимогами та вподобаннями. Це може бути як чинний дистриб’ютор або імпортер, так і незалежна компанія, наприклад Miasphera, яка не залучена в процес реалізації. Розглянемо детальніше обидва випадки.

Коли Уповноваженим представником є дилер-імпортер, виробник більшою мірою залежить від його умов. В цьому випадку представник-дилер часто діє у своїх інтересах, замикаючи постачання та продажі на собі та обмежуючи права дилерства для інших компаній. Крім цього він має додаткову конкурентну перевагу – його назва, як Уповноваженого представника, присутня на маркуванні або на інструкції усіх виробів.

Якщо Уповноваженим представником є компанія, яка не залучена в реалізацію продукції, виробник може самостійно обирати будь-яку кількість дилерів з якими хоче співпрацювати та на яких умовах.
Важливе уточнення! Кожен тип медичного виробу повинен бути пов’язаний лише з одним Уповноваженим представником.
Як бачимо, останній варіант має більше переваг для виробника, оскільки дозволяє регулювати кількість дилерів та надавати право на ввезення та дистриб’юцію своєї продукції іншим компаніям.
Маючи багаторічний досвід, компанія Maisphera пропонує незалежні послуги аутсорсингу Уповноваженого представництва. Ми працюємо з широким колом медичних, косметичних, харчових та ветеринарних товарів та завжди тримаємо руку на пульсі законодавчих нововведень.
Звертайтесь до нас та робіть важливий крок до успішного старту на українському ринку!
Дуже швидко промайнули ці незабутні три дні на головній події краси – виставці Pro Beauty Expo 2024. Відвідавши цей захід ми були приємно вражені злагодженою організацією та неймовірно стильними стендами компаній учасників, які залишили приємний присмак естетичного задоволення.
Наша команда отримала порцію весняного натхнення, заряд енергії та, звичайно, багато нових приємних знайомств та контактів в індустрії косметології.
І ось, трохи перевівши подих, неймовірно натхненні, ми починаємо планувати відвідини наступних заходів у сфері краси. Продовжуємо спілкування з усіма, з ким вже домовились про співпрацю.
Поглянемо як це було:





















В сучасному світі використання канабісу у будь-яких цілях завжди було предметом гострої уваги не тільки серед фахівців медичної галузі, а й громадськості. І наша країна не є винятком! Стадії легалізації можливості використання медичного канабісу в Україні досі проходять тернистий шлях законодавчих перипетій та змін.
Але за останній рік питання правового статусу канабісу та його легалізації в Україні значно просунулось.
13 лютого 2023 сталась важлива подія – президент України підписав закон №7457 про регулювання обігу медичного канабісу. Закон набуде чинності через шість місяців після оприлюднення.
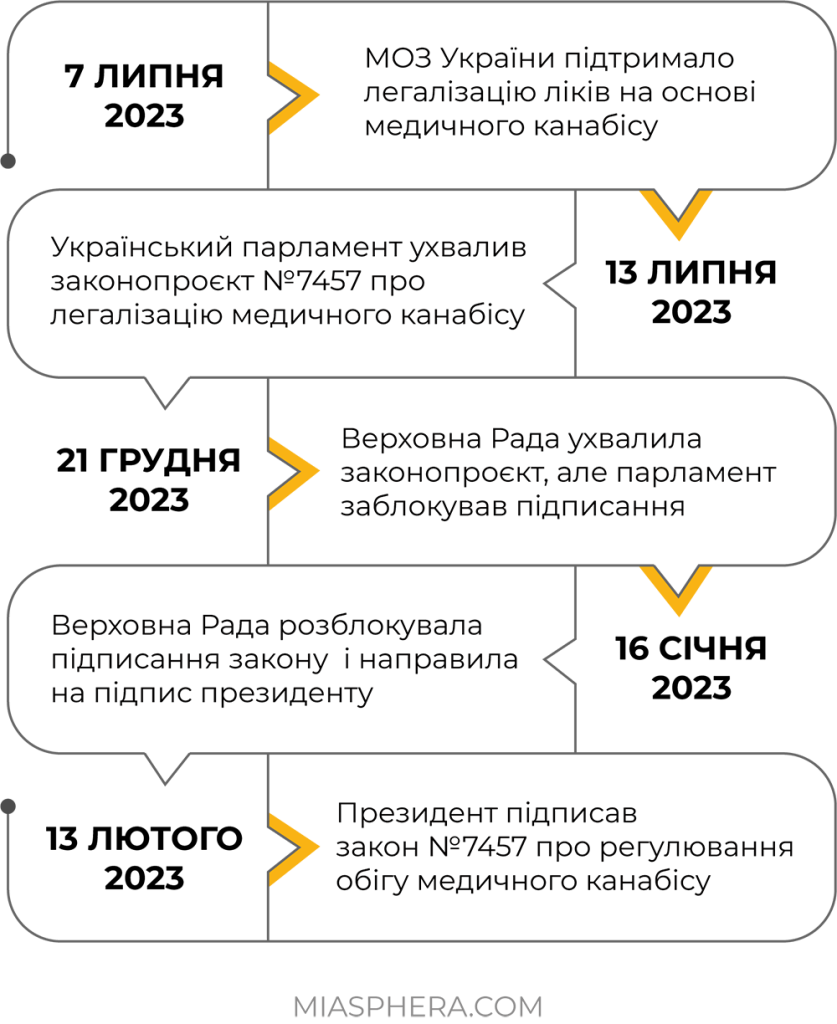
Основною метою закону є розширення доступу до препаратів медичного Cannabis для лікування низки хвороб. Так, за даними МОЗ, препаратів на основі канабісу наразі потребують понад 2 млн українців. Прийнятий закон декларує те, що обіг сортів рослин роду коноплі (Cannabis) для медичних цілей, продуктів їх перероблення та вироблених із них лікарських засобів, допускається лише з метою їх застосування у медичній, науковій та науково-технічній практиці.
Розповсюдження та споживання канабісу для рекреаційних цілей серед населення буде заборонено, тому потенційно важливим новим інструментом можна вважати запровадження системи простежуваності обігу сортів рослин роду коноплі.
Питання легалізації канабісу в Україні відкриває широкий простір для обговорення нових перспектив діяльності. Це може стати значним стимулом для розвитку нових галузей економіки не тільки у сфері виготовлення медичних та косметичних препаратів на основі рослин Cannabis, а й промисловому вирощуванню та обробці конопель. Інтерес становлять і подальші наукові дослідження властивостей наявних сортів конопель та їх підвидів.
В тому чи іншому випадку, прийняття закону не означає, що рослини роду коноплі (Cannabis) та препарати на їх основі будуть в широкому доступі для України вже в цьому році. Можна сміливо прогнозувати, що ще певний час після прийняття закону будуть формуватись визначені законопроєктом електронні реєстри, прописуватися алгоритми для контролю обігу рослин, умови надання квот тощо.

Про перспективи та умови легалізації діяльності пов’язаної з канабісом в Україні, розповідає Віталій Ковбаса – провідний адвокат консалтингової компанії Miasphera.
«Відкинувши скепсис та оцінивши ситуацію об’єктивно, можемо стверджувати, що даний процес не буде чітко визначеним у часі. Але тим, хто в майбутньому бажає займатися діяльністю пов’язаною з обігом сортів рослин роду коноплі (Cannabis), потрібно потурбуватись про правову сторону вже зараз. Найголовніше перед початком такої діяльності – це забезпечити наявність відповідних ліцензій та пройти відповідні процедури сертифікації» – коментує закон Віталій.
Що потрібно врахувати?
Ліцензування канабісу, а саме отримання ліцензії на:
Сертифікацію, а саме:
Отже, всі види діяльності, пов’язаної з обігом сортів рослин роду Cannabis, дозволяються виключно при наявності у суб’єктів такої діяльності відповідних ліцензій та при проходженні відповідних сертифікаційних процедур.
Дисклеймер: стаття не пропагує вживання наркотиків чи будь-яких інших заборонених речовин. Текст являє собою опис історії та наукових досліджень впливу канабісу на суспільство, людину, її фізичне та ментальне здоров’я.
Цікаві статті на тему канабісу:
Шановні клієнти та партнери!
Маємо для вас важливу новину – компанія Miasphera приєдналась до Асоціації «Операторів ринку медичних виробів» (AMOMD).
Асоціація «Операторів ринку медичних виробів» (AMOMD) – це єдине українське професійне об’єднання, яке включає близько 80 національних виробників, імпортерів, дистриб’юторів медичних виробів, косметичної продукції, засобів індивідуального захисту та дезінфекційних засобів.
Основна місія асоціації – це сприяння розвитку та правового захисту інтересів всіх учасників цього ринку. Така консолідація дає можливість підтримувати здорову конкуренцію в галузі, впливати на законодавче регулювання та захищати професійні інтереси учасників перед державою.
Наразі Miasphera активно просуває свої послуги саме для національних виробників медичних виробів, тому кооперація в межах Асоціації – це важливий крок до діалогу та налагодження нових партнерських стосунків.
Місія Miasphera – допомагати бізнесам розвиватись в межах законодавчих норм на території України, таким чином, роблячи свій вагомий внесок в розвиток медичної галузі країни.

Перші згадки про культивування канабісу людством датуються 4000 рр. до н.е. Володіючи потужними властивостями для поліпшення фізичного та психічного здоров’я, ця рослина протягом тисячоліть використовувалась як лікарський засіб, була джерелом їжі, волокон, масла та паперу.
Слід зазначити, що історія взаємовідносин людства з канабісом завжди зазнавала впливу різних культурних, соціальних та локальних тенденцій. Так, в античному Китаї та Індії канабіс використовували для лікування різних хвороб: при лікуванні запорів, малярії, ревматичних болях і жіночих недугах.
У середньовіччі канабіс поширився в Африці та в арабських країнах, де його використовували здебільшого в медицині, а також культурних та релігійних ритуалах. У Стародавній Греції марихуану вперше почали використовувати як знеболювальне під час операцій. В XV столітті канабіс поширився в Європі та Америці, де його використання набуло особливої популярності серед медиків та артистів.
На початку XX століття відбувся стрімкий ріст споживання канабісу, в тому числі завдяки його рекреаційним властивостям. Водночас попри велику популярність, канабіс почали масово забороняти. Все почалося з міжнародної опіумної конвенції, підписаної 1912 року. Вводився первинний контроль обігу важких наркотиків і конопель між країнами-учасницями: Німеччиною, Пруссією, Російською імперією, Великобританією, Нідерландами та багатьма іншими. Марихуану дозволялося виробляти та використовувати лише з медичною метою.
Впродовж 1930-х років у США виникла кампанія проти марихуани, а у 1937 році в США було введено закон про податок на канабіс.
Разом з тим популярність коноплі продовжувала зростати в промисловості, наприклад для виробництва мотузок, взуття та одягу. У 1942 році Генрі Форд створює експериментальний кузов з конопель, який виявився в 10 разів міцніший за сталь тієї ж товщини. Паливом для автомобіля мав слугувати конопляний біодизель.
У 1960-70-х роках, марихуана стає особливо популярною серед контркультурної молоді, які стають її основними споживачами. Вона стає своєрідним символом хіпі-руху, а також музичного та художнього самовираження. Саме в цей період канабіс стає об’єктом заборони у багатьох країнах через небезпеку зловживання та свої психотропні властивості. Світова історія канабісу отримує новий виток у березні 1961 року, коли ООН прийняла «Єдину конвенцію про наркотичні засоби». Внаслідок цього «канабіс, смола канабісу, екстракти та настоянки канабісу» були включені до переліку наркотичних засобів. Згідно з конвенцією, країни-підписанти були зобов’язані посилити контроль за культивуванням рослини, а її використання в інших цілях, крім медичних та наукових, повністю припинити. Під дію всесвітньої громадської заборони не попадало лише культивування промислових сортів.
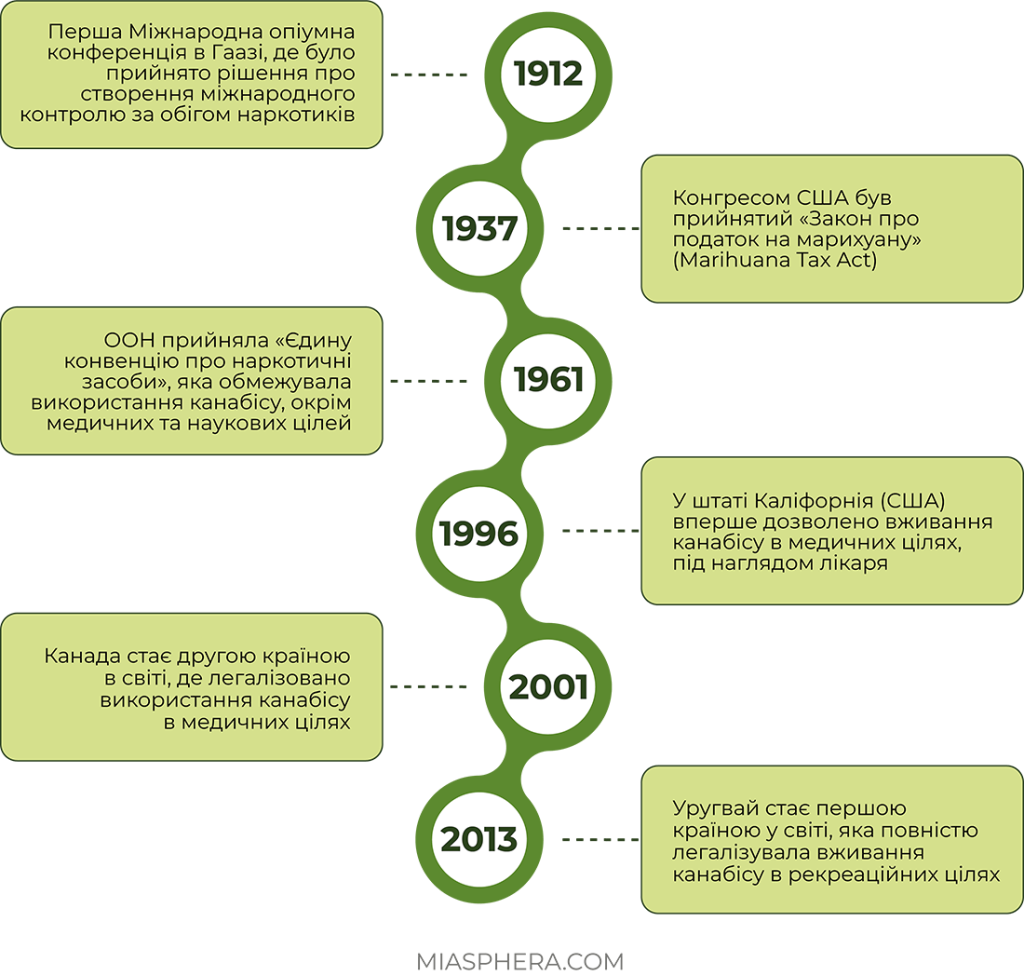
Вже в наприкінці XX століття багато країн почали процес легалізації канабісу для медичних та рекреаційних цілей, тим самим ламаючи традиційні стереотипи та розглядаючи нову перспективу для використання.
Легальний доступ до рослинного канабісу та його використання в медичних цілях під наглядом лікаря вперше було дозволено у штаті Каліфорнія (США) у 1996 році. Канада стала другою у світі країною, яка легалізувала використання канабісу в медичних цілях вже 2001 році, а в рекреаційних цілях – з 17 жовтня 2018 року.
10 грудня 2013 року Сенат Уругваю ухвалив закон, про повну декриміналізацію вирощування, продажу, купівлю та використання марихуани. Таким чином, Уругвай став першою країною у світі, яка повністю легалізувала канабіс.
У грудні 2020 року Комісія ООН з наркотичних речовин виключила медичні коноплі та всі її похідні зі списку критично небезпечних наркотиків, але близько 25 країн все ж проголосували проти цієї ініціативи.
Наразі світовий ринок канабісу, у тому числі й для медичного призначення, знаходиться у процесі стрімкого розвитку. Проте цей розвиток не є однорідним через різне правове середовище та неоднозначне ставлення громадськості.
На відміну від легалізації рекреаційного використання канабісу, все більше країн рік від року дозволяють його медичне використання. Останні 5 років близько 20 країн Європи (Греція, Естонія, Ірландія, Люксембург, Мальта, Македонія, Німеччина, Норвегія, Польща, Португалія, Хорватія), Північної та Південної Америки (Аргентина, Колумбія, Мексика, Перу, Чилі) та інші країни (Австралія, Філіппіни, Ямайка) легалізували канабіс та канабіноїди для медичних цілей у тому, чи іншому вигляді.
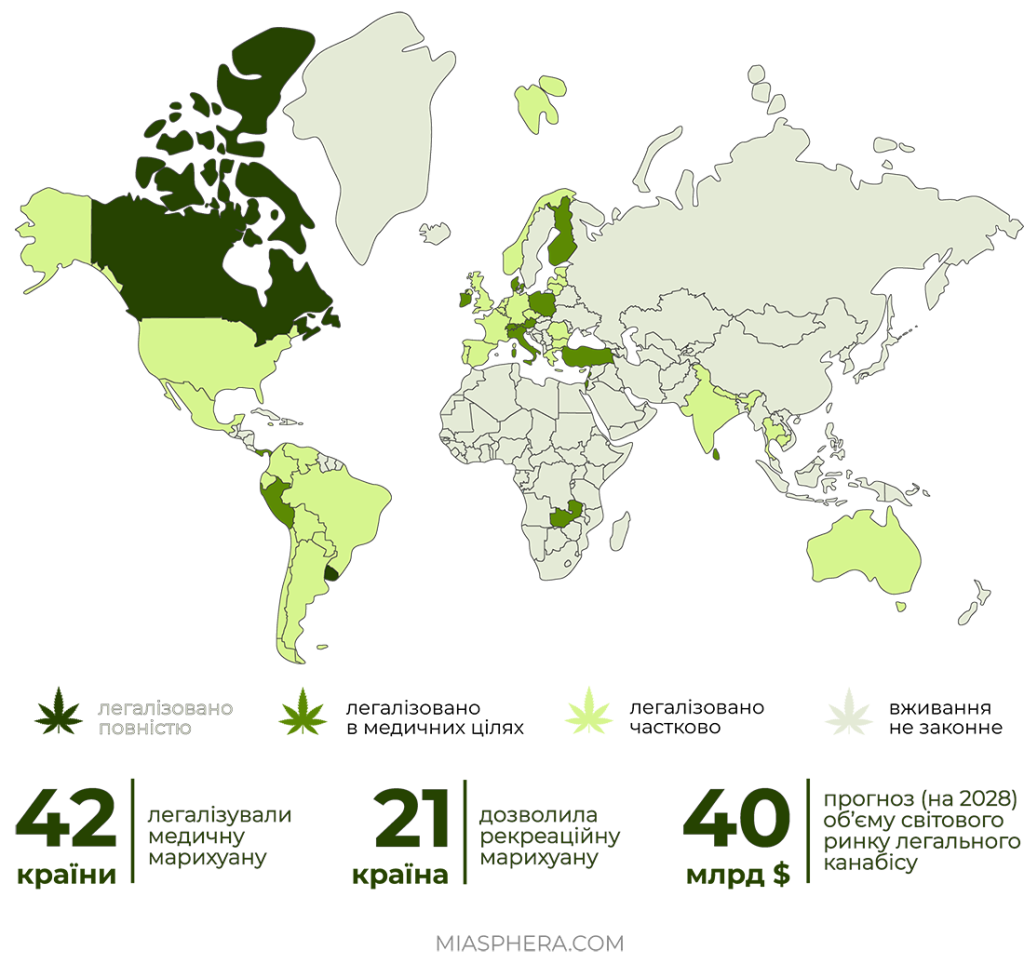
Деякі країни, такі як Канада та США, дозволяють вирощувати, споживати та роздрібно розповсюджувати різні продукти на основі канабісу. Так в Південній Африці, законодавчо дозволено вирощувати коноплі, але не легалізовано роздрібні продажі.
Попри повільні зміни у світі спостерігається лібералізація нормативно-правової бази міжнародних документів, що стосуються обігу сполук канабісу та канабіноїдів у медичних цілях та декриміналізація їх застосування. Такі лікарські засоби та препарати поступово стають доступними для пацієнтів в різних країнах.
Увага! Стаття розміщена з пізнавальною метою і не пропагує вживання наркотиків.
Більше про відмінності між поняттями «коноплі», «канабіс» та «марихуана» читайте в нашій статті за посиланням.