Процедура сертифікація партії медичних виробів– одна з основних легальних процедур, яка може бути застосована при реєстрації імпортованих медичних виробів в Україні.
Сертифікат відповідності на партію проводиться без виїзду експертів на місце виробництва. Фактично він видається на підставі чинного технічного файлу та огляду партії аудитором на митниці.
Отже, порядок проведення процедури зводиться до:
– оцінки наявного технічного файлу;
– підготовки інструкції та маркування під українське законодавство;
– оформлення договору на замовника чи Уповноваженого представника;
– аудиту партії безпосередньо на митниці;
– видачі сертифіката (орієнтовно від 3-5 днів);
– розмитнення, як медичного товару (зі ставкою оподаткування 7%).
Отримання сертифіката відповідності на партію медичного товару є економічно доцільним, якщо продукція ввозиться не системно або разово. Як правило, це постачання штучного медичного електрообладнання або однотипних медичних виробів (одна модель і одна марка).
Як довго триває процедура сертифікації партії?
Зазвичай 3-5 робочих днів, залежно від об’єму партії
До яких медичних виробів не може бути застосована процедура сертифікації партії?
– медичне програмне забезпечення;
– стерильна медична продукція;
– лабораторна апаратура, виготовлена по індивідуальному замовленню.
Бажаєте дізнатись можливість партійної сертифікації медичних виробів? Замовляйте попередню консультацію у фахівців Miasphera або телефонуйте +38 068 498 88 58
На ринку України присутній традиційно широкий асортимент дієтичних добавок. Вони охоплюють багато напрямків фізіологічної дії та мають різні форми випуску. Але часом, інформація на упаковці щодо властивостей дієтичних добавок може плутати покупців, особливо, якщо ці товари купуються в аптеках.
Тому виробнику дієтичних добавок слід приділяти особливу увагу маркуванню. Згідно з вимогами українського законодавства, вся обов’язкова інформація про продукт повинна бути надана безпосередньо на упаковці або етикетці.
Отже, коректно маркована дієтична добавка для виробника – це не тільки потужний стимул дати змогу споживачу зробити усвідомлений вибір, не вводячи його в оману, а й чітке дотримання вимог українського законодавства та мінімізація звернень з боку органів контролю.
Розуміння тонкощів сертифікації медичних виробів може здатись складним навіть для тих, хто вже неодноразово стикався з цією темою. Тому сьогодні ми поділимось корисною інформацією та розглянемо основні аспекти та питання, пов’язані з сертифікацією медичних виробів на території України.
Сертифікація медичних виробів – це процес оцінки відповідності медичного виробу вимогам Технічних регламентів, які підтверджують його безпеку та ефективність при використанні людиною.
Так! Оцінка відповідності виробів медичного призначення – це законодавча вимога, яка підтверджує їх законне введення в обіг на території України та подальшу реалізацію.
Відповідальність за декларування медичного виробу несе безпосередньо виробник або уповноважена особа, в разі, якщо медичні вироби імпортуються з інших країн.
Декларація складається під повну відповідальність виробника.
Процедура оцінки відповідності медичних виробів залежить від типу та класу безпеки медичного виробу.
Основними процедурами є самодекларування (для медичних виробів І класу ризику нестерильних, без функції вимірювання, для in vitro) та оцінка відповідності через аудит виробника (І стерильні, з функцією вимірювання, ІІа, ІІb, ІІІ).
В окремих випадках використовується процедура сертифікації партії або процедура з визнанням ЄС сертифікату.
Центральними органами регулювання та нагляду є Міністерство економічного розвитку та торгівлі, Міністерство охорони здоров’я та Держлікслужба України.
Безпосередньо оцінку відповідності медичних виробів в Україні проводять спеціально призначені органи з оцінки відповідності – акредитовані організації державної або приватної форми власності. Актуальний перелік призначених органів публікує Міністерство економічного розвитку і торгівлі.
Наші експерти супроводжують виробника на всіх етапах процедури оцінки відповідності, починаючи від консультації та збору документів і закінчуючи отриманням експертних висновків. Також ми надаємо повний юридичний супровід та послугу Уповноваженого представника.
Виникли додаткові питання? Залишайте заявку на консультацію або телефонуйте.
Ми завжди на зв’язку +38 068 498 88 58
Чи задумувались ви над тим, хто відповідає за якість та безпеку товарів імпорту? В Україні ця роль належить Уповноваженому представнику – юридичній або особі ФОП, яка має резидентство.
Слід зазначити, що наявність уповноваженого представника для будь-якого виробника-нерезидента є вимогою українського законодавства. Тому одним з перших кроків процесу сертифікації медичних виробів або косметики є призначення Уповноваженого представника виробника в Україні. Авторизований Уповноважений представник діє як офіційний посередник між виробником та ринком України, в тому числі з державними установами, відповідальними за ринковий нагляд.
Уповноважений представник має певні обов’язки, визначені Технічними регламентами та законодавчими актами:
Зазвичай, іноземні виробники обирають уповноваженого представника за власними вимогами та вподобаннями. Це може бути як чинний дистриб’ютор або імпортер, так і незалежна компанія, наприклад Miasphera, яка не залучена в процес реалізації. Розглянемо детальніше обидва випадки.

Коли Уповноваженим представником є дилер-імпортер, виробник більшою мірою залежить від його умов. В цьому випадку представник-дилер часто діє у своїх інтересах, замикаючи постачання та продажі на собі та обмежуючи права дилерства для інших компаній. Крім цього він має додаткову конкурентну перевагу – його назва, як Уповноваженого представника, присутня на маркуванні або на інструкції усіх виробів.

Якщо Уповноваженим представником є компанія, яка не залучена в реалізацію продукції, виробник може самостійно обирати будь-яку кількість дилерів з якими хоче співпрацювати та на яких умовах.
Важливе уточнення! Кожен тип медичного виробу повинен бути пов’язаний лише з одним Уповноваженим представником.
Як бачимо, останній варіант має більше переваг для виробника, оскільки дозволяє регулювати кількість дилерів та надавати право на ввезення та дистриб’юцію своєї продукції іншим компаніям.
Маючи багаторічний досвід, компанія Maisphera пропонує незалежні послуги аутсорсингу Уповноваженого представництва. Ми працюємо з широким колом медичних, косметичних, харчових та ветеринарних товарів та завжди тримаємо руку на пульсі законодавчих нововведень.
Звертайтесь до нас та робіть важливий крок до успішного старту на українському ринку!
Всі медичні вироби класифікуються залежно від конструкції, особливостей застосування та потенційної загрози у разі їх неправильного використання. Тому перед початком процесу сертифікації, виробник медичного виробу повинен визначити його медичне призначення та передбачуване використання.
Кожна країна встановлює до них власні вимоги. Наразі в Україні діє класифікатор медичних виробів НК 024:2023, створений на основі міжнародної номенклатури GMDN.
Клас безпеки медичного виробу залежить від потенційного ризику при його застосуванні споживачем. Медичні вироби класифікують за критеріями: інвазивності, тривалості застосування, наявності контакту з тілом людини, дією на життєво важливі органи людини, а також можливості застосування джерел енергії разом з виробом.
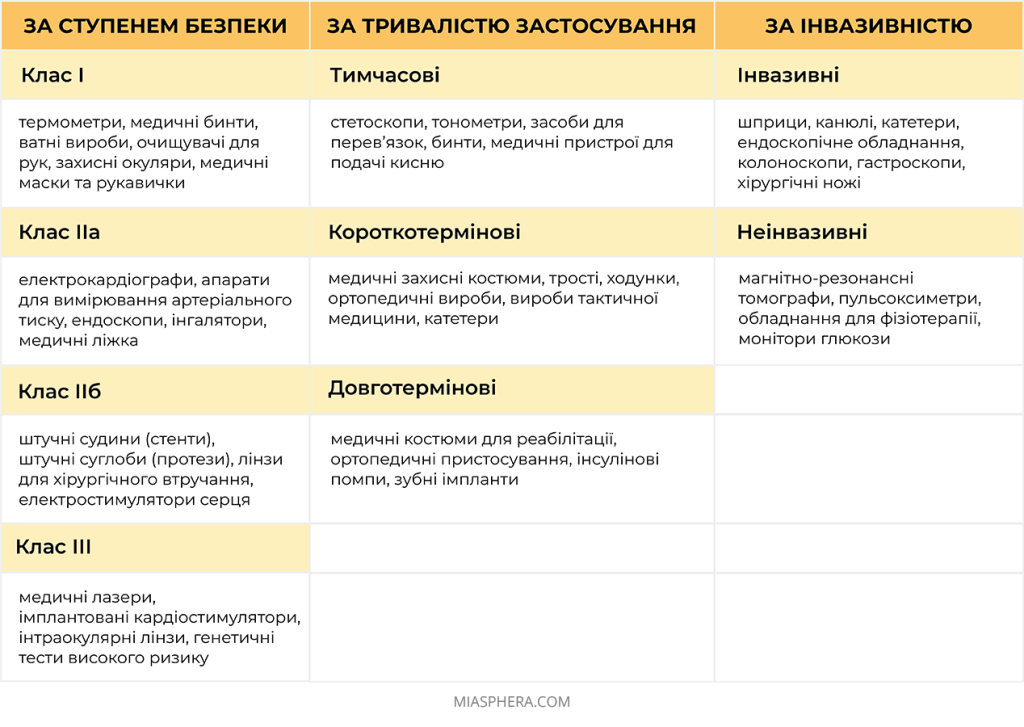
Отже, за ступенем безпеки медичні вироби поділяються на:
Клас I — невисока доля ризику
Клас ІІа — середня доля ризику
Клас ІІб — підвищена доля ризику
Клас III — висока доля ризику
За тривалістю застосування медичні вироби бувають:
Тимчасові – для неперервного застосування до 60 хвилин;
Короткотермінові – для неперервного застосування до 30 днів;
Довготермінові – для неперервного застосування терміном від 30 днів.
За інвазивністю медичні вироби бувають:
Неінвазивні – це медичні прилади або засоби, які не потребують вторгнення чи проникнення в організм людини для проведення діагностики, моніторингу або лікування.
Інвазивні – це медичні вироби, які повністю або частково вводяться в організм людини через його поверхню або отвір тіла.
Прийняті класи безпеки медичних виробів відображають потенційний ризик у разі використання їх споживачами. Тому, залежно від визначеного класу та характеристик, процедура сертифікації медичного виробу може відрізнятись. Адже чим вищий клас ризику, тим складнішою та довшою є процедура реєстрації.
Помилки при визначенні класу можуть коштувати дорого при подальшій реалізації продукції. Тому якщо ви маєте сумніви з коректної класифікації власного виробу – звертайтесь до спеціалістів Miasphera! Ми з радістю надамо вичерпні консультації та запропонуємо оптимальні варіанти сертифікації для вашого продукту.
Залишити заявку на консультацію.
«Реєстрація косметики в Україні» – один з популярних запитів у пошукових системах. Це й не дивно, адже трендом останнього десятиліття є зростання косметичного ринку, на що вказує стабільне підвищення обсягів виробництва та реалізації косметичних засобів. Косметика давно стала не просто продуктом для догляду, а й необхідним елементом повсякденного використання людини.
Український ринок косметичних виробів не є виключенням. Тому питання появи нових продуктів, збільшення кількості виробників та технічне регулювання обігу косметики є нагальним питанням для українського законодавства.
Чи обов’язкова сертифікація косметики та коли вступає в дію новий Технічний регламент? – на ці та інші питання відповідає головний юрист компанії MIASPHERA – Віталій Ковбаса.
Перед початком опису процедури, надамо трохи теорії та розуміння терміну «косметичні засоби» з боку українського законодавства.
Косметичні засоби в Україні регулюються відповідно до Закону «Про косметичні засоби» від 05.04.2012 № 4616-VI.
Косметичною продукцією може вважатись будь-яка речовина або суміш речовин, які призначені для використання на зовнішніх ділянках тіла людини з метою їх очищення, ароматизування, відновлення, захисту та коригування запаху.
Кожен іноземний виробник чи імпортер який виводить косметичні засоби на ринок України, проходить полегшену процедуру декларування відповідності. Оскільки косметика з ЄС вже відповідає нормам, які тільки будуть впроваджені в нашій державі. Імпортеру достатньо надати сертифікат від виробника та паспорт безпеки на продукцію.
Національний виробник проходить цю процедуру через отримання висновку санітарно-епідеміологічної експертизи на виробництво та продукцію.
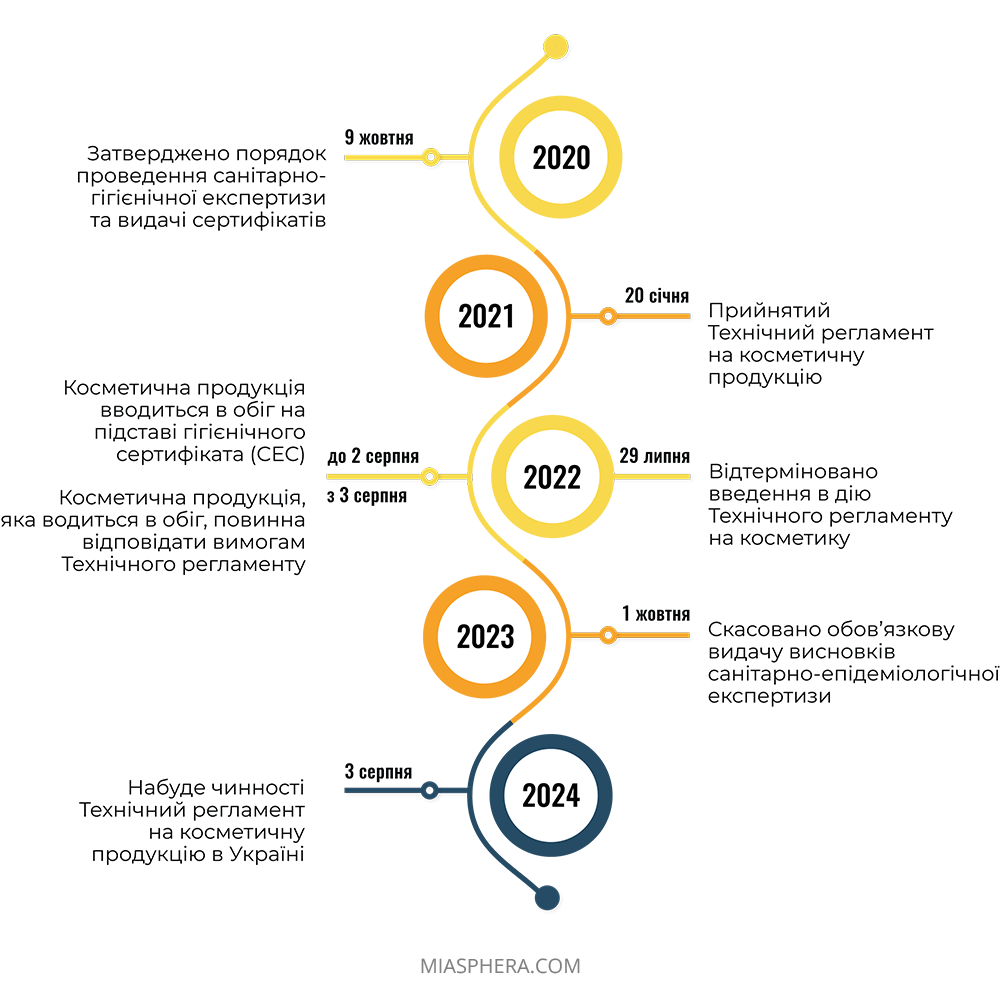
Наразі та до повного введення в дію Технічного регламенту, реєстрація косметичних засобів в Україні для національного виробника здійснюється через добровільне отримання висновку санітарно-гігієнічної експертизи (СЕС), який підтверджує безпеку продукції для здоров’я людини та надає право на її продаж.
Процес регулювання косметичної продукції в Україні активно інтегрується з законодавством Європейського союзу. На підставі Регламенту ЄС №1223/2009 було розроблено технічний регламент на косметичну продукцію для України. Цей нормативний акт неодноразово переносився, але все ж був прийнятий Кабміном 20 січня 2021 року.
У зв’язку з воєнними діями МОЗ запропонувало відкласти набрання чинності Технічного регламенту до 3 серпня 2024 року та запровадили перехідний період для учасників ринку косметичної продукції до 3 серпня 2026 року.
Основна мета запровадження Технічного регламенту – це встановлення нових стандартів до косметичних продуктів на ринку України, визначення прав та обов’язків учасників ринку щодо введення косметичної продукції в обіг, а також усунення адміністративних бар’єрів в торгівлі з країнами Європейського союзу.
Після набуття чинності технічного регламенту, процес реєстрації косметичної продукції стане кардинально новим.

Слід зазначити, що перехідний період, власне до моменту вступу в силу Технічного регламенту, дає час операторам ринку, щоб підготуватись. Реалізація косметики, яка виготовлена до 03.08.2026, не буде заборонена або обмежена до реалізації наступні 5 років.
Якщо ви виробник косметичних засобів та плануєте подальший розвиток власного виробництва, слід вже зараз стратегічно підходити до цього питання. Перехідний період в законодавстві – це завжди час додаткових дій та нових кроків. Щоб не втрачати час та уникнути ряду прикрих помилок при реєстрації косметичних засобів за новими правилами – звертайтесь до MIASPHERA!
Ми надамо повну юридичну підтримку та супровід на всіх етапах виводу косметичної продукції на ринок України! Фахівці MIASPHERA радо поділяться своїм успішним досвідом!
Що Miasphera може зробити для виробника косметики:
Ми завжди йдемо на крок попереду та працюємо за новими стандартами!
Бажаєте отримати консультацію? Залишайте заявку за посиланням.
Якщо ви виробник або експортер косметичної продукції та маєте бажання підкорювати ринок країн Євросоюзу – вам обов’язково необхідно пройти процедуру реєстрації ваших косметичних засобів.
Процедура проходить через оцінку відповідності косметичних виробів згідно з регламентами та директивам ЄС. Простіше кажучи: ваш продукт має відповідати стандартам ЄС на даний вид виробу.
Регламент забороняє вихід на ринок ЄС косметичних продуктів, інгредієнти або кінцевий склад яких випробовувались на тваринах. Речовини, які є канцерогенними, мутагенними чи токсичними для репродуктивного здоров’я також заборонені до використання.
Оцінка відповідності складається з проходження двох головних процедур: складання звіту з безпеки продукції (CPSR) та нотифікації. Звучить страшнувато, але в даній статті ми пояснимо це заплутане питання.
Отже, косметичні вироби охоплюють широкий спектр товарів, але все ж вони мають одну спільну рису – безпосередньо контакт з тілом людини. Саме ця особливість і є причиною ретельного вивчення фізико-хімічних показників будь-якого косметичного продукту.
Щоб впевнитися, що досліджуваний товар безпечний для використання, складається звіт з безпеки (CPSR), згідно з Додатком I Регламенту про косметику. Він містить важливі дані про результати досліджень складу та окремих компонентів, які можуть нести потенційні ризики для споживача. В процедуру також включено оформлення інформаційного файлу, де на кожен засіб зазначено відповідне маркування та умови відповідності виробництва законодавством ЄС.
Нотифікація – це процес внесення косметичної продукції в загальноєвропейську базу даних (CPNP), який проводиться на підставі звіту про безпеку продукту (про який сказано вище).
Отже, розібравшись з визначенням основних термінів, ми можемо сформувати етапи, на шляху до успішної процедури оцінки відповідності косметичних засобів:

Слід зазначити, що успішне проходження першого етапу дає змогу сформувати дорожню карту всього шляху реєстрації продукту, від якої й буде формуватися остаточний перелік необхідних документів для формування досьє – PIF файлу.
Звертаємо увагу, що у випадку реєстрації косметичної продукції на території країн Європейського Союзу, необхідно потурбуватись про наявність уповноваженого представника.
Ця відповідальна особа зареєстрована на території країни ЄС, володіє повною інформацією про продукцію, несе юридичну відповідальність за дотримання вимог по нормативах косметики та за потреби надає усю необхідну інформацію на запит наглядових органів для контролю та моніторингу діяльності.
Відповідно до Косметичного Регламенту (ЄС) No 1223/2009, уповноважений представник несе юридичну відповідальність за косметичний продукт не європейського виробника на ринку ЄС.
Всі косметичні продукти, що надходять на ринок ЄС, повинні мати наступний пакет документів:

Паспорт безпеки (MSDS) косметичної продукції розробляється на підставі даних виробника та уповноваженої особи. Він містить більш детальну інформацію про: склад, можливі ризики шкоди людині, правила поведінки в разі неправильного використання, умови зберігання та утилізації. Цей документ є важливим не лише для експортних операцій, а й для кінцевого споживача, щоб забезпечити правильне і безпечне використання товару.
У разі невідповідності косметики встановленим нормам безпеки певної країни або при поданні неповного пакета документів у реєстрації може бути відмовлено.
Бажаєте дізнатись про послугу більше?
Залишайте заявку на консультацію на сайті або телефонуйте нам! Звільніть свій час для більш важливих бізнес-процесів, а решту довірте фахівцям Miasphera! Ми працюємо по всій Україні!
Реєстрація виробів медичного призначення в Україні як і в інших країнах світу передбачає собою їх легалізацію та необхідна для введення виробником в обіг виробів медичного призначення.
З 2015 року в Україні змінено процедуру державної реєстрації медичних виробів і впроваджено процедуру оцінки відповідності вимогам технічних регламентів щодо медичних виробів, у тому числі для діагностики in vitro та активних медичних виробів, які імплантують, що передбачено Законом України «Про технічні регламенти та оцінку відповідності».
Найважливіше про що варто одразу зазначити, на даний час в Україні не скасовані карантинні заходи направленні на запобігання та попередження поширення COVID-19, та на превеликий жаль через військову агресію (війну) рф проти України, процедура оцінки відповідності вимогам технічних регламентів щодо медичних виробів із залученням призначеного органу тимчасово відбувається дистанційно. Дистанційний аудит виробника медичних виробів має такі переваг як: швидкість аудиту та вартість такого аудиту. Виробнику виробів медичного призначення не потрібно оплачувати переліт аудиторів та перекладача з України в країну виробництва виробів медичного призначення, оплачувати кошти на проживання в готелі, добові витрати тощо.
Відповідно реєстрація виробів медичного призначення в Україні здійснюється згідно до порядку, визначеного Технічним регламентом, що залежить типу та класу ризику виробу медичного призначення.
Перший спосіб є найпростішим та передбачає завершення внутрішнього контролю оформленням та підписанням під цілковиту відповідальність виробника декларації про відповідність виробів медичного призначення вимогам технічних регламентів. По результату внутрішнього контролю, уповноважений представник, отримані документи від виробника на вироби медичного призначення – технічний файл, розроблені етикетки, інструкції зберігає не тільки на час реалізації виробів медичного призначення, але й до 15 років після реалізації останнього виробу. Після оформлення декларації, отримання документів на вироби медичного призначення, уповноважений представник повинен здійснити внесення запису до Реєстру осіб відповідальних за введення медичних виробів у обіг. Від дня внесення такого запису, виробник та/або його уповноважений представник мають право здійснювати імпортування виробів медичного призначення в Україну за пільговою ставкою податку на додану вартість та здійснювати реалізацію таких виробів на ринку України.
В загальному порядку, другий спосіб є більш складним та тривалішою процедурою, що поділяється на декілька етапів: звернення до органу з оцінки відповідності з відповідною заявою, до якої додаються анкетні форми, списки виробів медичного призначення; проходження експертизи документів на вироби медичного призначення – технічного файлу; аудит системи управління якістю виробника. За результатом аудиту призначений орган з оцінки відповідності видає сертифікат про відповідність. Після отримання сертифікату про відповідність, виробник та/або уповноважений представник здійснює оформленням та підписанням під цілковиту відповідальність виробника декларації про відповідність виробів медичного призначення вимогам технічних регламентів.
На даний час існують всі передумови для того щоб реєстрація виробів медичного призначення в Україні була вигідною для виробника, коштувала в рази дешевше та проводилася швидше. Зрештою, саме час для світових виробників виробів медичного призначення відкрити для себе медичний ринок України, та посісти в ньому гідне місце. Реєстрація виробів медичного призначення в Україні, які через відновлення критичної медичної інфраструктури є вкрай необхідні по всім медичним направленням, надасть світовому виробнику перевагу в освоєнні медичного ринку України.