Компанія Miasphera розповіла журналістам про міфи щодо вживання медичного канабісу
16 серпня 2024 року буде введений у дію Закон України «Про внесення змін до деяких законів України щодо державного регулювання обігу рослин роду коноплі (Cannabis)» № 3528-IX. Він покликаний легалізувати обіг рослин роду конопель (канабіс) у медичних, промислових цілях, науковій та науково-технічній діяльності.
Закон викликав чимало гострих дискусій у суспільстві, а також спровокував появу міфів щодо використання медичного канабісу. На професійній дискусійній панелі «Легалізація медичного канабісу: потреба, необхідність, ризики» виділили головні з них.
Насправді є достатньо наукових даних, які підтверджують, що застосування ліків на основі медичного канабісу є ефективними при лікуванні понад 50 патологічних станів, серед них:
• неврологічні захворювання;
• захворювання травного тракту;
• хронічний біль невропатичного походження;
• при наданні паліативної допомоги тощо.
В Україні це питання особливо актуальне для наступних категорій людей:
• діти з епілепсією;
• онкохворі;
• хворі, які потребують паліативної допомоги (при невиліковних хворобах);
• ветерани війни з ПТСР.
Нині використання медичного канабісу схвалили вже 56 країн. Зокрема, Німеччина, Іспанія, Нідерланди, Італія, Чехія, Франція, Португалія, Польща, Греція, Австрія, Данія, Бельгія, Норвегія, а також Ізраїль, Великобританія, США та Канада.
Закон чітко регламентує діяльність із вирощування сортів рослин роду коноплі лише в медичних, промислових, наукових та науково-технічних цілях. Будь-яке інше використання — заборонене. Держава суворо контролюватиме обіг ліків на основі канабісу, а застосування його у рекреаційних цілях, як і раніше, залишиться під забороною і вважатиметься злочином.
Щоб виготовляти і відпускати ліки на основі медичного канабісу, аптека має отримати ліцензію на здійснення діяльності з обігу наркотичних засобів, психотропних речовин та прекурсорів та ліцензії на право провадження господарської діяльності з виробництва лікарських засобів.
Ірина Морозова, засновниця компанії Miasphera надала свій експертний коментар cайту itnews: «Для пацієнтів із певними хворобами/станами легалізація медичного канабісу є порятунком. Препарати на його основі показали свою ефективність при важких формах онкології, безсонні, неврологічних захворюваннях, хронічних болях, розсіяному склерозі, ВІЛ/СНІД, хворобі Крона, хворобі Альцгеймера та інших. Також ці засоби широко використовуються для паліативної допомоги та для полегшення стану пацієнтів з епілепсією. Яскравий приклад — синдром Драве. Це важка форма епілепсії в дітей, яка має генетичні передумови та не корелюється лікарськими засобами».
Натхненна після травневої подорожі у Львів, команда Miasphera готова поділитись своїми враженнями від участі у Львівському медичному форумі та виставки ГалМЕД.
Медичний форум, що відбувся 21-23 травня, об’єднав понад 60 компаній-учасників з України та Європи, які представили сучасне медичне, стоматологічне та реабілітаційне обладнання, вироби медичного та лабораторного призначення, харчові добавки, а також новітні методики лікування.
Вся команда Miasphera ретельно готувалась до події та була неймовірно задоволена стати учасником та офіційним партнером такого масштабного заходу. Нас чекали корисні знайомства, ділові дискусії, безліч нової інформації і, звісно, трохи чарівного старовинного Львова у вільний від роботи час 🙂
В рамках виставки ГалМЕД, Miasphera організувала науково-практичну конференцію, яка була присвячена легалізації медичного канабісу та сертифікації медичних виробів. Ми залучили до професійної дискусії лікарів, юристів, фармацевтів та фахівців дотичних до галузі.
Тема медичного канабісу викликала жваву дискусію серед присутніх, а переповнений конференц-зал був прямим підтвердженням неабиякої актуальності даного питання. Ми віримо, що наш фокус на використанні канабісу в медичних цілях знайде ще більше зацікавлених серед професійної медичної спільноти України.
Miasphera вдячна усім, хто взяв активну участь в конференції та розділив ідею легалізації та потенціалу використання канабісу у медичних цілях.
Львівський медичний форум став однією з найбільших медичних подій України, і від імені усієї команди ми безмежно вдячні організаторам, партнерам та нашим ЗСУ за можливість взяти участь у подібному заході!
І наостанок, традиційно презентуємо невеличкий фотозвіт з місця подій
























Також наша компанія стала організатором дискусійної панелі, на тему: Актуальні виклики при легалізації медичного канабісу в Україні. Запис, ви можете подивитись на нашому Youtube каналі:
Batch certification is one of the main legal procedures. It can be applied for registration of imported medical devices in Ukraine.
The certificate of conformity for the batch is issued without experts going to the place of production. In fact, it is issued on the basis of a valid technical file and inspection of the lot by an auditor at customs.
Therefore, the procedure for carrying out the procedure is reduced to:
– acquaintance with the technical file;
– preparation of instructions and labeling under Ukrainian legislation;
– drawing up a contract for the customer or Authorized Representative;
– audit of the batch directly at customs;
– certificate issuance (approximately 3 – 5 days);
– customs clearance as a medical product (with a tax rate of 7%).
Obtaining a certificate of conformity for a batch of medical goods is economically feasible if the products are not imported systematically or once. As a rule, this is the supply of artificial medical electrical equipment or medical products of the same type (one model and one brand).
Would you like to learn about the possibility of batch certification of medical products?
Order a preliminary consultation from Miasphera by +38 068 498 88 58
Процедура сертифікація партії медичних виробів– одна з основних легальних процедур, яка може бути застосована при реєстрації імпортованих медичних виробів в Україні.
Сертифікат відповідності на партію проводиться без виїзду експертів на місце виробництва. Фактично він видається на підставі чинного технічного файлу та огляду партії аудитором на митниці.
Отже, порядок проведення процедури зводиться до:
– оцінки наявного технічного файлу;
– підготовки інструкції та маркування під українське законодавство;
– оформлення договору на замовника чи Уповноваженого представника;
– аудиту партії безпосередньо на митниці;
– видачі сертифіката (орієнтовно від 3-5 днів);
– розмитнення, як медичного товару (зі ставкою оподаткування 7%).
Отримання сертифіката відповідності на партію медичного товару є економічно доцільним, якщо продукція ввозиться не системно або разово. Як правило, це постачання штучного медичного електрообладнання або однотипних медичних виробів (одна модель і одна марка).
Як довго триває процедура сертифікації партії?
Зазвичай 3-5 робочих днів, залежно від об’єму партії
До яких медичних виробів не може бути застосована процедура сертифікації партії?
– медичне програмне забезпечення;
– стерильна медична продукція;
– лабораторна апаратура, виготовлена по індивідуальному замовленню.
Бажаєте дізнатись можливість партійної сертифікації медичних виробів? Замовляйте попередню консультацію у фахівців Miasphera або телефонуйте +38 068 498 88 58
The Lviv Medical Forum 2024 has ended, and we would like to share our results and impressions. The event brought together more than 60 participating companies from Ukraine and Europe. They presented modern medical, dental and rehabilitation equipment, medical and laboratory products, food supplements and latest treatment methods.
Miasphera’s team carefully prepared for the event and was incredibly pleased to become a participant and official partner of such a large-scale event. Useful acquaintances, business discussions, a lot of new information and, of course, a bit of charming old Lviv in our free time from work awaited us.
As part of the GalMED exhibition, Miasphera organized a scientific and practical conference about the legalization of medical cannabis and the certification of medical products. We involved doctors, lawyers, pharmacists and specialists related to the medical industry in the professional discussion.
The topic of medical cannabis caused a lively discussion among the guests. It indicates the great relevance of this issue. We believe this focus on the use of cannabis for medical purposes will find even more interest among the professional medical community in Ukraine.
Miasphera is grateful to everyone who took an active part in the conference and shared the idea of legalization and the potential of using cannabis for medical purposes. Also, we are immensely grateful to the organizers, partners and our Armed Forces for the opportunity to participate in such an event!
And finally, we traditionally present a small photo report.
























There is traditionally a wide range of dietary supplements on the market of Ukraine. They cover many directions of physiological action and have different forms of release. But sometimes, the information on the package about the properties of dietary supplements can confuse consumers, especially if these products were bought in pharmacies.
Therefore, the manufacturer of dietary supplements should pay special attention to labeling. According to the requirements of Ukrainian legislation, all mandatory information about the product must be provided directly on the package or label.
So, a correctly labeled dietary supplement for the manufacturer is not only a powerful incentive to enable the consumer to make an informed choice without misleading him, but also a clear compliance with the requirements of Ukrainian legislation and a minimization of appeals from control authorities.
На ринку України присутній традиційно широкий асортимент дієтичних добавок. Вони охоплюють багато напрямків фізіологічної дії та мають різні форми випуску. Але часом, інформація на упаковці щодо властивостей дієтичних добавок може плутати покупців, особливо, якщо ці товари купуються в аптеках.
Тому виробнику дієтичних добавок слід приділяти особливу увагу маркуванню. Згідно з вимогами українського законодавства, вся обов’язкова інформація про продукт повинна бути надана безпосередньо на упаковці або етикетці.
Отже, коректно маркована дієтична добавка для виробника – це не тільки потужний стимул дати змогу споживачу зробити усвідомлений вибір, не вводячи його в оману, а й чітке дотримання вимог українського законодавства та мінімізація звернень з боку органів контролю.
Understanding the intricacies of medical device certification can seem difficult even for those who have already encountered this topic many times. Therefore, we are sharing useful information and considering the main aspects and issues related to the certification of medical devices on the territory of Ukraine.
Let’s go!
Certification of medical devices is a process of assessing the compliance of a medical device with the requirements of the Technical Regulations. Certification confirms the safety and effectiveness of medical devices used by humans.
Of course! Compliance assessment of medical devices is a legal requirement. This confirms the legal introduction of medical products into circulation on the territory of Ukraine and their subsequent sale.
The responsibility for declaring the medical product lies directly with the manufacturer or an authorized person, in case the medical products are imported from other countries. The declaration is made under the full responsibility of the manufacturer.
The procedure for evaluating the conformity of medical devices depends on the type and safety class of the medical device. The main procedures are self-declaration (for medical devices of the I-risk class, non-sterile, without a measurement function, for in vitro) and assessment of conformity through the manufacturer’s audit (I-sterile, with a measurement function, IIa, IIb, III).
In some cases, the batch certification or the procedure with EU recognition of the certificate is used.
The centers of regulation and supervision are the Ministry of Economic Development and Trade, the Ministry of Health and the State Medical Service of Ukraine.
Assessment of the conformity of medical products in Ukraine is carried out by specially accredited conformity assessment organizations of state or private ownership. The current list of accredited organizations is published by the Ministry of Economic Development and Trade.
Our experts accompany the manufacturer at all stages of the conformity assessment procedure, starting from consultation and collecting documents and ending with obtaining expert opinions. We also provide full legal support and Authorized Representative services.
Have additional questions? Leave a request for a consultation or call us.
We are always in touch +38 068 498 88 58
Розуміння тонкощів сертифікації медичних виробів може здатись складним навіть для тих, хто вже неодноразово стикався з цією темою. Тому сьогодні ми поділимось корисною інформацією та розглянемо основні аспекти та питання, пов’язані з сертифікацією медичних виробів на території України.
Сертифікація медичних виробів – це процес оцінки відповідності медичного виробу вимогам Технічних регламентів, які підтверджують його безпеку та ефективність при використанні людиною.
Так! Оцінка відповідності виробів медичного призначення – це законодавча вимога, яка підтверджує їх законне введення в обіг на території України та подальшу реалізацію.
Відповідальність за декларування медичного виробу несе безпосередньо виробник або уповноважена особа, в разі, якщо медичні вироби імпортуються з інших країн.
Декларація складається під повну відповідальність виробника.
Процедура оцінки відповідності медичних виробів залежить від типу та класу безпеки медичного виробу.
Основними процедурами є самодекларування (для медичних виробів І класу ризику нестерильних, без функції вимірювання, для in vitro) та оцінка відповідності через аудит виробника (І стерильні, з функцією вимірювання, ІІа, ІІb, ІІІ).
В окремих випадках використовується процедура сертифікації партії або процедура з визнанням ЄС сертифікату.
Центральними органами регулювання та нагляду є Міністерство економічного розвитку та торгівлі, Міністерство охорони здоров’я та Держлікслужба України.
Безпосередньо оцінку відповідності медичних виробів в Україні проводять спеціально призначені органи з оцінки відповідності – акредитовані організації державної або приватної форми власності. Актуальний перелік призначених органів публікує Міністерство економічного розвитку і торгівлі.
Наші експерти супроводжують виробника на всіх етапах процедури оцінки відповідності, починаючи від консультації та збору документів і закінчуючи отриманням експертних висновків. Також ми надаємо повний юридичний супровід та послугу Уповноваженого представника.
Виникли додаткові питання? Залишайте заявку на консультацію або телефонуйте.
Ми завжди на зв’язку +38 068 498 88 58
Have you thought about who is responsible for the quality and safety of imported goods? In Ukraine, this role belongs to the Authorized Representative. This is a legal entity or an individual entrepreneur who has residency.
The presence of an authorized representative for any non-resident manufacturer is a requirement of Ukrainian legislation. Therefore, one of the first steps in the process of certification of medical products or cosmetics is the appointment of the authorized representative of the manufacturer in Ukraine. The authorized representative acts as an official intermediary between the producer and the Ukrainian market, including with state institutions responsible for market surveillance.
An Authorized Representative has certain duties. These duties are defined by the Technical Regulations and legislative acts:
Usually, foreign manufacturers choose an authorized representative according to their own requirements and preferences. This can be an existing distributor or an independent company such as Miasphera.
Let’s consider both cases in more detail.
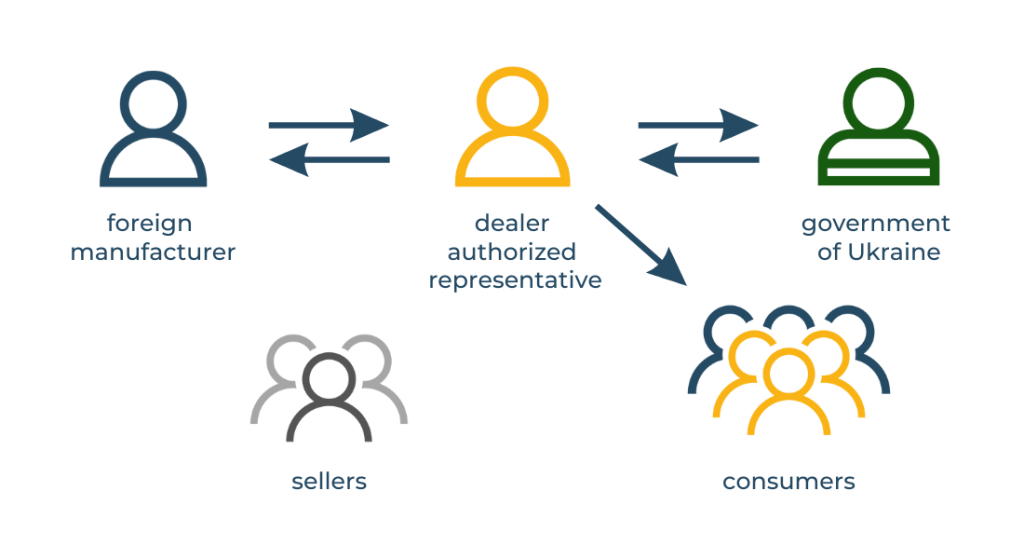
If the authorized representative is a dealer-importer, the manufacturer is more dependent on its conditions. In this case, the representative-dealer often acts in his own interests, closing the supply and sales to himself and limiting the rights of the dealership to other companies. In addition, he has an additional competitive advantage – his name, as an Authorized Representative, is present on the labeling or on the instructions of all products.

If the Authorized Representative is a company that is not involved in the sale of products, the manufacturer can independently choose any number of dealers with whom he wants to cooperate.
Important clarification! Each type of medical device must be associated with only one Authorized Representative.
As you can see, the last option has more advantages for the manufacturer, as it allows you to regulate the number of dealers and grant the right to import and distribute your products to other companies.
Miasphera offers independent outsourcing services of the Authorized Representation, because we have many years of experience.
We work with a wide range of medical, cosmetic, food and veterinary products and always keep our finger on the pulse of legislative innovations.
Contact us and take an important step towards a successful start on the Ukrainian market!